Abstrakt
Těžké popáleninové trauma je příčinou hypermetabolické reakce. Tato komplexní patofyziologická odpověď je charakterizována systémovými změnami, které vedou k výraznému proteinovému katabolismu, steatóze jater, vyšší náchylnosti k infekcím a dysfunkci orgánových systémů. Molekulární podstata a klinická relevance tohoto jevu stále není zcela objasněna. Terapeutickým cílem je zmírnění hypermetabolického a hyperkatabolického stavu, prevence sekundárních postižení, zastavení svalového úbytku, umožnění časné rehabilitace a navrácení nemocného zpět do běžného života.
Tento článek shrnuje metabolické změny způsobené popáleninovým traumatem a možnosti léčby zaměřené na modulaci těžkého katabolismu.
Klíčová slova: popáleniny, hypermetabolismus, katabolismus bílkovin, inzulinová rezistence, časná rehabilitace
Abstract
Severe burn trauma is a cause of hypermetabolic reaction. This complex pathophysiological response is characterized by systemic changes leading to marked protein catabolism, hepatic steatosis, increased susceptibility to infections, and organ dysfunction. Molecular nature and clinical relevance of this phenomenon are still not fully understood. The therapeutic goal is to attenuate hypermetabolic and hypercatabolic state, prevent secondary injuries, stop muscle wasting, enable early rehabilitation and return the patient to normal life.
This article summarizes metabolic changes caused by large burn trauma and treatment options aimed at modulation of severe catabolism.
Key words: burns, hypermetabolism, protein catabolism, insulin resistance, early physiotherapy
Úvod
Ve světovém měřítku každoročně zemře více než 300 000 pacientů na popáleninový úraz (1). V posledních desetiletích bylo dosaženo významného pokroku v péči o popálené pacienty díky vybudování specializovaných popáleninových center, zdokonalení chirurgické terapie pomocí časné excize a pokrytí popálené plochy, adekvátní tekutinové terapii, výživové podpoře a pokroku v technikách podpory životních funkcí (1–4). Všechny tyto progresivní postupy významně zvyšují šanci na přežití popáleného.
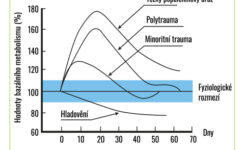
Popáleniny postihující více než 40 % celkového povrchu těla (TBSA) vedou k hypermetabolické reakci, která může přetrvávat dva až tři roky po poranění (3, 4). Metabolické a zánětlivé změny jsou podobné změnám pozorovaným u pacientů s polytraumatem (5); jejich závažnost a perzistence jsou však u pacientů s popáleninami obvykle mnohem významnější (6–8).
Typickým projevem těžkého popáleninového traumatu je prudké zvýšení metabolismu (4, 7, 8). Úroveň tohoto nárůstu je úměrná velikosti popálené plochy (2, 3). U většiny těžce popálených pacientů hodnoty bazálního metabolismu (BMR) dosahují ve srovnání s BMR před úrazem až 140 % při přijetí, 180–200 % při nekrektomiích, 130 % při úplném zhojení popálené plochy, 120 % po 6 měsících po traumatu a 110–120 % po dalších 12 měsících (2, 4).
Tento hypermetabolický stav je doprovázen katabolismem svalových proteinů, inzulinovou rezistencí, hyperglykemií, náchylností k infekcím a sepsi, častějším výskytem multiorgánových dysfunkcí a orgánových selhání a zpomalením růstu u dětí (7).
Metabolická odpověď na popáleninový úraz
Při akutní stresové reakci rozlišujeme období časné a pozdní. U pacientů s jiným život ohrožujícím poraněním nebo onemocněním trvá akutní fáze zpravidla 10 dnů, zatímco u popálených přetrvává do té doby, dokud není popálená plocha zhojena nebo chirurgicky uzavřena.
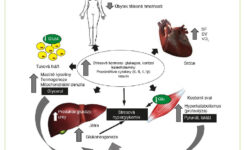
Příčinou většiny metabolických změn v časném období akutní fáze (první 2 až 3 dny po úrazu), je vysoká hladina stresových hormonů, tj. noradrenalinu a adrenalinu (8). Rychlost degradace endogenních steroidů je snížena, a to při zvýšené sekreci kortizolu (9). Do krve se uvolňují adenohypofyzární hormony a zvyšují se hladiny vazopresinu a angiotenzinu II (10). V játrech se aktivuje glykogenolýza. V cytosolu buněk se glukóza přeměňuje na laktát, který je uvolněn do oběhu. Aktivuje se lipolýza, zvyšují se plazmatické koncentrace volných mastných kyselin.
Pozdní období akutní fáze je charakterizováno různým stupněm systémové zánětlivé odpovědi, která je řízena kortizolem a cytokiny. Hlavní metabolickou charakteristikou je glukoneogeneze, která probíhá v játrech a v ledvinné kůře, a jejímiž substráty jsou některé tří- a čtyřuhlíkové molekuly, zvláště pak laktát, pyruvát, glycerol, alanin a glutamin. Glukoneogeneze může vyprodukovat až 10 g glukózy na kg tělesné hmotnosti za den (12). Aktivuje se lipolýza, ale zvýšené hladiny inzulinu částečně tento efekt inhibují. Hladina cholesterolu v plazmě je nízká, protože jeho syntéza je energeticky náročná a zvyšuje se jeho spotřeba (pro syntézu kortizolu a hojení a růst buněčných membrán) (13).
Tento stav je projevem metabolické dysfunkce. Inzulinová rezistence způsobuje intracelulární nedostatek glukózy v inzulin-dependentních tkáních (v kosterních svalech a tukové tkáni), zatímco hyperglykemie může působit toxicky v inzulin-nondependentních tkáních (nervová tkáň, krevní buňky) a zvýšit glykaci proteinů a enzymatických systémů s poruchou jejich funkce, tj. zapříčinit tzv. karbonylový stres (14). Hyperinzulinemie snižuje tvorbu ketonů v játrech. Energetickým substrátem pro některé tkáně tedy zůstávají pouze aminokyseliny (zejména rozvětvené). Tělesné bílkoviny jsou autokanibalizovány. Ztráta 40 % tělesných proteinů a více má téměř 100 % mortalitu (4, 6).
Lipolýza zvyšuje koncentrace volných mastných kyselin v plazmě, což přispívá k ukládání tuků v orgánech a zvyšuje rezistenci na inzulin (3, 4, 7). Steatóza jater je u popálených velmi častá a je spojena se zvýšeným výskytem infekcí a sepse (15). Bylo prokázáno, že existuje vztah mezi metabolismem glukózy a ukládáním tuků a že volné mastné kyseliny zhoršují inzulinem stimulovanou spotřebu glukózy prostřednictvím inhibice aktivního transportu glukózy (16).
Ztráta periferního podkožního tuku může také hrát roli ve vývoji a přetrvávání inzulinové rezistence po těžkém popáleninovém úrazu (17). Sidossis a kolektiv potvrdili, že podkožní bílá tuková tkáň u popálených dětí může přijmout fenotyp podobný hnědé tukové tkáni, který je spojen se zvýšením metabolismu (18). To znamená, že bílá tuková tkáň se může transformovat z typu energeticky akumulačního do typu energeticky uvolňujícího. Jinými slovy: tuková tkáň se stane více termogenní v reakci na těžké popáleninové trauma. Tato fenotypová transformace byla pozorována jak na zvířecích modelech, tak u popálených pacientů. Tzv. browning tukové tkáně hraje význačnou roli v hypermetabolismu popáleninové traumatu a jeho další výzkum by mohl objasnit základní mechanismus této reakce (19).
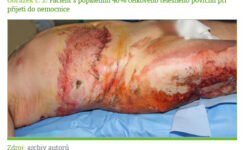
Akutní fáze popáleninového traumatu je charakterizována častými sekundárními inzulty. Nezbytnými pro přežití pacienta jsou opakované nekrektomie, odběr dermoepidermálních štěpů ze zdravých částí těla a autotransplantace. Časté jsou i převody krevních derivátů. Opakovaně může docházet ke ztrátě tělesného tepla, lokální a systémové infekci a k selhávání orgánů. Tyto inzulty udržují v chodu hyperinflamatorní stav a vedou k proteinovému katabolismu velkého rozsahu, který může způsobit život ohrožující sarkopenii.
Nefarmakologické intervence
Teplota vnějšího prostředí
Lidská kůže hraje při izolaci těla a celkově v termoregulaci zásadní roli. Těžce popálení pacienti ztrácejí schopnost regulovat teplotu tělesného jádra. Značná část vody a tepla se ztrácí nekontrolovaným pocením a radiací. Organismus se reaktivně pokouší zvýšit teplotu o 2 °C nad normální hodnotu, což je provázeno zvýšením energetického výdeje prostřednictvím zvýšené mitochondriální termogeneze (6). Wilmore a kolektiv zjistili, že zvýšení teploty okolního prostředí z 25 na 33 °C může snížit REE z 200 % na 140 % u pacientů s popáleninami na 40 % TBSA a více (20). REE lze dále snížit krytím popálených ploch obvazy (2).
Nekrektomie a autotransplantace
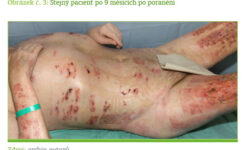
Časná nekrektomie a uzavření ranné plochy je pravděpodobně nejvíce revolučním poznatkem v péči o popálené za poslední dvě desetiletí. Odstranění nekrotické tkáně a pokrytí ranných ploch značně tlumí hypermetabolickou odpověď (2–7) a významně snižuje sepsi a mortalitu (21). Časná autotransplantace je také spojena s nižší závažností hypertrofických jizev a kloubních kontraktur a přispívá k rychlejší rehabilitaci popálených (1, 6). Ukázalo se, že časná nekrektomie a pokrytí ranné plochy u pacientů popálených na > 50 % TBSA během prvních tří dnů vede ke snížení REE o 40 % ve srovnání s kontrolními pacienty po obdobném popáleninovém traumatu, u nichž byla nekrektomie a pokrytí ranné plochy provedena za 7 dnů po poranění (2, 6). Hart a kolektiv ukázali, že nekrektomie a autotransplantace do 72 hodin po poranění zabraňují ztrátě bílkovin a snižují výskyt sepse ve srovnání s pacienty s excizí provedenou za 10 až 21 dní po vzniku termického traumatu (22).
Adekvátní výživa
Výživa je při léčbě popálených klíčová. Primárním cílem nutriční podpory je pokrytí energetických nároků organismu v hypermetabolickém stavu, udržení správné funkce orgánů a přežití nemocného. Preferovaná cesta podání výživy je enterální (23). Enterální výživa zamezuje translokaci bakterií, udržuje motilitu střev a zachovává přirozený tok živin ze střeva do jater. S ohledem na časté poruchy střevní pasáže je ale doplňková parenterální výživa u rozsáhle popálených obvykle nezbytná.
Rehabilitace a fyzioterapie
Fyzioterapie a rehabilitační programy jsou u těžce popálených indikovány i kvůli metabolické resuscitaci a jako prevence kontraktur (2, 3, 5, 6, 7). Rehabilitace může u těchto pacientů obnovit svalovou hmotu a zlepšit svalovou sílu. Zvyšuje citlivost na inzulin, upravuje lipidový profil, zlepšuje funkci kardiorespiračního aparátu a normalizuje perfuzi končetin (6). Také zkracuje dobu pobytu jak na ventilátoru, tak na jednotce intenzivní péče a v nemocnici a má pozitivní efekt na výsledný funkční stav zraněného (24).
Obecně lze konstatovat, že čím dříve se rehabilitace zahájí, tím lépe pro pacienta. Nicméně klidový režim nutný pro přihojování štěpů zahájení fyzioterapie odsunuje. Pacient po rozsáhlém termickém úrazu musí být po dobu několika týdnů téměř bez pohybu. Navíc je umístěn ve speciálním vzdušném lůžku, kde jsou minimalizovány proprioceptivní podněty. To se spolupodílí na svalové devastaci. Otázka volby optimální fyzioterapie a její správné načasování tak zůstává stále otevřena.
Farmakologické intervence
Rekombinantní lidský růstový hormon (rhGH)
Denní intramuskulární injekce rekombinantního lidského růstového hormonu během období akutní reakce významně ovlivňuje popáleninový hypermetabolismus. Podávání rhGH značně tlumí reakci akutní fáze v játrech, zlepšuje produkci albuminu, udržuje svalovou hmotu, má pozitivní modulační účinek na imunitní odpověď, tlumí hypermetabolismus, snižuje srdeční výdej a zkracuje dobu hojení odběrové plochy přibližně o 1,5 dne (25). Nicméně podávání rhGH u popálených dospělých pacientů má vedlejší účinky, jako jsou hyperglykemie a inzulinová rezistence (2, 4, 5). Takala a kolektiv zjistili, že podávání vysokých dávek rhGH dospělým v intenzivní péči zvyšuje morbiditu a mortalitu v důsledku hyperglykemie a inzulinové rezistence, tudíž se podávání rhGH ani u dospělých popálených pacientů nedoporučuje (26). U popálených pediatrických pacientů tento účinek nebyl pozorován a rhGH se používá během chronické fáze léčby k udržení fyziologického růstu dítěte. Během akutní fáze popáleninové nemoci je ale podávání rhGH dětem spojeno se zvýšeným rizikem septických příhod (2, 26, 27).
Inzulinu podobný růstový faktor (IGF-1)
IFG-1 je primárním mediátorem účinků rhGH (4, 6, 7). Podávání samotného IGF-1 popáleným pacientům prokázalo zvýšení syntézy bílkovin v periferních svalech, vedlo však také k epizodám hypoglykemie (2, 4, 6). Pokud byl IGF-1 vázán v molárním poměru 1 : 1 na svůj vazebný protein (IGFBP-3) a byl podáván v této kombinaci, proteinový metabolismus dospělých i dětských popálených pacientů byl zlepšen, aniž by nastaly hypoglykemické epizody (2, 4, 5). Herndon prokázal, že IGF-1/IGFBP-3 v dávkách 1 až 4 mg/kg/den zmírňuje katabolismus u popálených dětí (28). Ukázalo se ale, že podání toho komplexu zvyšovalo výskyt neuropatie u popálených pacientů. Jeho použití je v současné době experimentální (29).
Oxandrolon
Oxandrolon je analog syntetického steroidu a má pouze dvacetinu účinku testosteronu. Metaanalýza patnácti RCT podávajících oxandrolon rozsáhle popáleným v různých fázích popáleninové nemoci dospěla k závěrům, že oxandrolon u popálených nemá vliv na mortalitu, nemá vliv na počet infekčních komplikací, nepůsobí hepatotoxicky, zkracuje délku hospitalizace, vede k menšímu váhovému úbytku, zlepšuje nárůst beztukové tělesné hmoty a snižuje ztráty dusíku (30).
Propranolol
Před již téměř 50 lety Wilmore a kolektiv zjistili, že blokáda β-adrenergních receptorů tlumí hypermetabolismus (31). Propranolol, neselektivní β-blokátor, je podáván k utlumení hypermetabolické odpovědi mediované adrenergními hormony. Byl široce studován u popálených dětí, u nichž vedl ke zvýšené proteosyntéze (32). U dospělých pacientů je studií s propranololem málo. Metaanalýza bezpečnosti a efektivity propranololu u rozsáhle popálených dětí a dospělých neprokázala snížení mortality a incidence infekcí ani zkrácení doby hospitalizace. Jeho podávání bylo u dospělých spojeno s významně menším množstvím krevních převodů a s pomalejší srdeční frekvencí (33).
Inzulin
Inzulin je anabolický, antiapoptotický a protizánětlivý hormon, který se běžně používá k léčbě poúrazové hyperglykemie. Podávání inzulinu během akutní fáze nemoci zlepšuje metabolismus svalových bílkovin, snižuje riziko infekce a zkracuje dobu hojení odběrové plochy (34). Intenzivní inzulinová terapie je však spojena s nežádoucími hypoglykemickými epizodami, a proto je doporučeno podávat inzulin tak, aby se glykemie udržovala v pásmu 7–10 mmol/l (35).
Metformin
Metformin snižuje hyperglykemii inhibicí glukoneogeneze a zvyšuje citlivost na inzulin. Není spojen s hypoglykemickými příhodami a může tedy být bezpečnou volbou pro léčbu hyperglykemie u popálených (36). Kontraindikací je přítomnost nebo vysoké riziko laktátové acidózy, zvláště u pacientů s určitým stupněm renální dysfunkce (37).
Fenofibrát
Fenofibrát se používá při léčbě dyslipidemie a cukrovky. Dvoutýdenní léčba fenofibrátem zvýšila oxidaci tuků a zlepšila citlivost k inzulinu, významně snížila hladinu glukózy bez nežádoucí hypoglykemie, snížila jaterní glukoneogenezi a zlepšila mitochondriální funkce u popálených dětí (38). Práce podobného typu u dospělých v kritickém stavu ale chybějí. Nedostatkem případné terapie fenofibrátem je nemožnost parenterálního podávání. Rizikem jsou jeho kumulace při renální insuficienci a rhabdomyolýza. Ta hrozí zvláště u nemocných s hypoalbuminemií, ledvinovou nedostatečností a s hypotyreoidismem, což jsou klinické stavy v popáleninové medicíně relativně časté.
Závěr
Metabolická odpověď na popáleninový úraz je charakterizována vysokým metabolickým obratem, který přetrvává i několik let po dohojení. Patofyziologické mechanismy tohoto jevu nejsou zcela jasné, spolupodílet se může i přeměna bílého tuku na hnědý. Časná nekrektomie a pokrytí popálené plochy je pravděpodobně nejúčinnějším opatřením ke zmírnění hypermetabolismu a hyperkatabolismu. Zvýšené nutriční požadavky musí být hrazeny formou vysokokalorické diety, u rozsáhle popálených i umělou výživou. Fyzioterapie a rehabilitační programy jsou nezbytné u těžce popálených nejen z hlediska pohybového aparátu, ale jako významné proanabolické opatření.
V současné době neexistuje dostatečně účinný farmakologický preparát, který by jednoznačně snižoval proteinový katabolismus u dospělých popálených pacientů. U pediatrické populace jsou farmakologické intervence účinnější.
MUDr. Magdalena Švecová
Klinika popáleninové medicíny 3. lékařské fakulty
Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha
e-mail: magdalena.svecova@lf3.cuni.cz
MUDr. Robert Zajíček, Ph.D.
Klinika popáleninové medicíny 3. lékařské fakulty
Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha
MUDr. Bohumil Bakalář
Klinika anesteziologie a resuscitace 3. lékařské fakulty
Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha