I. Aminokyseliny u onemocnění ledvin
Summary
Amino acids play a key role in proteosynthesis and are also involved in a number of intermediate metabolic cycles. In kidney diseases, the grade of the renal function decrease is related to a change of amino acid spectrum. The levels of essential branched-chain AAs (leucine, isoleucine, valine) responsible for protein synthesis are reduced and, at the same time, the levels of non-essential amino acids involved in the urea cycle (ornithine, citrulline, and/or arginine) and in the transport of NH2- groups (glutamine) are increased. Amino acid substitutions should respect the changes. Adequate amount of energy, best in form of saccharides, must be given to reduce the gluconeogenesis of gluconeoplastic AAs (alanine). The level of AAs catabolism can be assessed form waste urea in urine. Ketoanalogues may replace essential AAs in proteosynthesis in case of reduction of nitrogen catabolites formation. Their use is limited by adequate intake of energy necessary for transamination of keto- and hydroxy- analogues.
Key words: Essential amino acids, non-essential amino acids, semi-essential amino acids, renal function, amino solutions, ketoanalogues
1. Role aminokyselin v organismu
Aminokyseliny (AMK) jsou základní stavební jednotky bílkovin. Hladiny AMK v plazmě jsou poměrně nízké, což znamená podobný aktivní metabolický obrat jako u glukózy či mastných kyselin. Hladina AMK v krevní cirkulaci je dlouhodobě stabilní, a to i v době protrahovaného lačnění či při bezprostředním příjmu proteinů, který zajišťuje tzv. tkáňový pool AMK. Z biologického hlediska je potřebných všech 20 základních AMK, které tvoří primární strukturu proteinů v organismu. Z tohoto počtu si osm nedokáže lidský organismus syntetizovat a musejí být přijaty potravou, jsou proto esenciální (leucin, izoleucin, valin, methionin, fenyl-
alanin, lysin, threonin, tryptofan). Druhá skupina, neesenciální, (glycin, k. glutamová, glutamin, serin, taurin, alanin, ornitin, cystein, prolin, hydroxyprolin, k. asparagová, asparagin) může být dospělým zdravým jedincem syntetizována. Za určitých okolností, jako při zvýšené potřebě v období růstu nebo v rekonvalescenci či při některých stavech (renální selhání a maligní nádorové onemocnění), se stávají některé neesenciální AMK deficitní: jedná se o arginin (prekurzor radikálu NO), histidin a tyrozin (renální selhání), ev. i cystein, glycin, glutamin a taurin. Tyto aminokyseliny jsou semiesenciální nebo podmíněně esenciální.(1)
Za normálních okolností u zdravého jedince zajišťuje neustálý transfer AMK mezi játry a dalšími orgány trvalou dostupnost utilizovatelného dusíku. Do jater je většina dusíku transportována z jiných tkání ve formě glutaminu nebo alaninu.
V době lačnění dochází k uvolňování AMK ze svalů a plic.Více než 50 % AMK uvolňovaných ze svalů tvoří alanin a glutamin; vznikají z pyruvátu, resp. z glutamátu. Aminoskupina přenášená na prekurzory těchto AMK pochází z rozvětvených AMK. Do jater se vrací z kosterního svalstva především alanin, který tvoří po oxidační deaminaci pyruvát, a je tak hlavním zdrojem novotvořené glukózy při glukoneogenezi (alanin-glukózový cyklus). Vylučování urey močí je tak mírou glukoneogeneze z alaninu v játrech, který sem přichází z kosterního svalstva. Infuze 100-200 g glukózy u pacientů v těžkém stavu může ušetřit až 2/3 svalových proteinů, jejichž AMK (alanin) slouží při nedostatku glukózy jako substrát pro glukoneogenezi. Do střevní sliznice se dostává ze svalů glutamin, kde slouží částečně jako zdroj energie (po přeměně na glutamát a 2-oxoglutarát, který je součástí citrátového cyklu). Glutamin, který přichází do ledvin, je zdrojem amonných iontů vylučovaných do moči. Odbourávání AMK, a to jak přijatých potravou, tak vytvořených v organismu, začíná odstraněním amino-
skupin (oxidační deaminace) a pokračuje metabolizací uhlíkového skeletu. Katabolismus uhlíkového skeletu vyúsťuje především v tvorbu intermediálních produktů citrátového cyklu, čímž je umožněna interkonverze uhlíkového skeletu AMK na skelet glukózy (glukoneogeneze) nebo ketolátek (ketogeneze), ev. cholesterolu a lipidů (lipogeneze). Specifické postavení v metabolismu mají AMK s rozvětveným řetězcem (leucin, isoleucin, valin).(2,3)
2. Funkce ledvin a metabolismus aminokyselin
Poznatek o existenci poruchy metabolismu bílkovin u nemocných s chronickým selháním ledvin má dlouholetou historii. V souladu s historickou tézí Giordana lze predikovat: pokud organismus dostává denně dostatečné množství esenciálních aminokyselin, stává se limitujícím faktorem pro udržení dusíkové rovnováhy dusík pocházející z neesenciálních aminokyselin. Za těchto podmínek může být využito ke stavbě bílkovin i dusíku pocházejícího z močoviny. Utilizace dusíku urey u nemocných v chronické renální insuficienci může být relativně vysoká (30-40 %). Lepší využití aminokyselin při nedostatečném příjmu bílkovin je umožněno zvýšenou aktivitou proteosyntetických enzymů v játrech, snížením jejich oxidace a snížením aktivity enzymů ureového cyklu. Pro přepočet vyloučeného množství urey v moči na příjem bílkovin či aminokyselin je nutno vědět, že z 1 g bílkovin vzniká přibližně 5,5 mmol urey a 80 % vytvořené urey se vylučuje močí. K prakticky snadno dosažitelným indikátorům intenzity proteinového metabolismu patří výpočet množství metabolizovaného (a za předpokladu vyrovnané dusíkaté bilance i přijatého) proteinu na podkladě množství urey vyloučené do moči v mmol za 24 hodin: (urea × V) × 0,25 (za předpokladu, že se fekálně vylučuje u těchto nemocných kolem 0,031 g N/kg/den).
Spektrum aminokyselin v séru se při renální insuficienci zásadně mění. Snižují se koncentrace esenciálních aminokyselin (EAK) s výjimkou fenylalaninu. Koncentrace neesenciálních aminokyselin (NEAK) se většinou naopak zvyšuje. Snižuje se také poměr EAK:NEAK. Toto snížení je však výrazně ovlivňováno stavem nutrice. Vylučování aminokyselin do moči se při renální insuficienci podstatně nemění, což je způsobeno – při snížené glomerulární filtraci – zvýšenou frakční exkrecí aminokyselin.(4)
Koncentrace aminokyselin v séru závisí na jejich intracelulárním metabolismu. Koncentrace volných aminokyselin je v intracelulární tekutině podstatně vyšší, než je v tekutině extracelulární. Tyto aminokyseliny pak mohou být transportovány do extracelulárního prostoru (např. při poklesu sérových hladin aminokyselin při ztrátách vyvolaných hemodialýzou). Snížené hladiny rozvětvených esenciálních aminokyselin jsou jedním z typických nálezů u nemocných v chronické renální insuficienci. Také hladina serinu může být významně snížena, neboť ledviny jsou hlavním místem jeho tvorby. Mohou být ovlivněny hladiny dalších hydroxyaminokyselin (glycin a threonin). Hladiny alaninu a glutaminu bývají většinou normální a tyto aminokyseliny představují v postdigesční fázi hlavní zdroj dusíku pro ledviny a splanchnické orgány. Jejich hladina je výrazně ovlivňována dietou, stejně jako stupněm vychytávání (metabolizace) v uvedených orgánech.
Stejně tak se zvyšují hladiny některých aminokyselin ureového cyklu (především citrulinu, zatímco arginin zůstává většinou normální), aminokyselin obsahujích síru (cystinu, homocysteinu, event. cysteinu, zatímco hladina methioninu zůstává normální), prolinu, hydroxyprolinu a 3-metylhistidinu.
Pro malnutrici je typický pokles tělesné hmotnosti, tělesného tuku, svalové hmoty a intracelulární vody. Klesají hladiny albuminu, transferinu, cholinesterázy, komponent komplementového systému, především C3 složky. Stejně se snižují hladiny valinu, leucinu, izoleucinu, tryptofanu a tyrozinu, poměr celkových esenciálních aminokyselin k neesenciálním, valinu ke glycinu a tyrozinu k fenylalaninu, hladina glycinu je často zvýšena.
Tryptofan je jediná aminokyselina vázaná na bílkoviny séra a je mimořádně významná z hlediska zahájení proteosyntézy. Koncentrace tryptofanu v séru při CHRI bývá normální nebo lehce snížená. Mění se však poměr volného a vázaného tryptofanu. Koncentrace vázaného tryptofanu se snižuje, zvyšuje se koncentrace volného tryptofanu. Tryptofan je zdrojem indolových látek, jejichž koncentrace se v renální insuficienci zvyšuje.
Porucha metabolismu fenylalaninu a tyrozinu je známa již delší dobu. Uvádí se, že zvýšená hladina fenylalaninu, jeho zpomalená metabolizace a snížený poměr tyrozinu k fenylalaninu mohou být způsobeny jak snížením hladiny ledvinné fenylalaninhydroxylázy, tak změnou intra/extracelulární distribuce.
Je známou skutečností, že histidin je esenciální aminokyselinou pro nemocné v chronické renální insuficienci. Jeho plazmatické koncentrace bývají nízké, buď pro sníženou syntézu jeho prekurzoru (kyseliny imidasolpyrohroznové), nebo pro sníženou schopnost transaminovat tuto ketokyselinu (snížená aktivita transketolázy v chronické renální insuficienci).
Závažný příspěvek v hodnocení metabolického stavu nemocných v chronické renální insuficienci přinesly studie zabývající se intracelulární koncentrací aminokyselin, především ve svalové hmotě. Jak známo, kosterní svaly představují hlavní zásobní zdroj volných aminokyselin. V chronické renální insuficienci se mění extra/intracelulární distribuce některých aminokyselin, takže plazmatické hladiny nejsou odpovídajícím odrazem hladin intracelulárních. Tato skutečnost se např. týká pro metabolismus velice důležitých, tzv. rozvětvených, aminokyselin: leucinu, izoleucinu a valinu. Při snížené plazmatické hladině těchto tří aminokyselin byly popsány normální intracelulární koncentrace leucinu a izoleucinu (valin byl snížen) a tyto rozdíly přetrvávaly i při dlouhodobé nízkobílkovinné dietě doplněné esenciálnímu aminokyselinami. Selektivní deplece valinu, a to přes vysoký příjem, ukazovala, že tato aminokyselina byla zvýšeně katabolizována a při uvedené suplementaci esenciálních aminokyselin vznikl mezi valinem a leucinem s izoleucinem tzv. aminokyselinový antagonismus. Podobně byla zjištěna výrazně snížená intracelulární hladina tyrozinu při relativně zvýšené hladině plazmatické. Threonin byl nalezen snížený jak v plazmě, tak ve svalu. Naproti tomu aminokyseliny ureového cyklu: citrulin, ornitin a arginin byly nalezeny zvýšené jak ve svalu, tak v séru.
Je tedy zřejmé, že syntéza bílkovin v chronické renální insuficienci může být výrazně limitována intracelulárním obsahem aminokyselin, především pak nízkou koncentrací valinu, threoninu a tyrozinu a u neléčených též histidinu.
3. Podávání aminokyselin při onemocnění ledvin
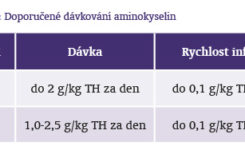
Aminokyseliny jsou základními jednotkami pro výstavbu proteinů. K tomu je potřeba 20 aminokyselin, z nichž osm je esenciálních. Při umělé výživě roztoky aminokyselin je důležitá nejen jejich dávka, ale i vzájemný poměr jednotlivých aminokyselin. Při použití nevyvážených aminokyselinových roztoků, tj. těch, které nemají správný poměr aminokyselinn, může dojít k závažným dysbalancím, které jsou nebezpečnější než při perorálním přívodu aminokyselin. Aminokyselinové směsi používané v parenterální výživě mají jednak charakter výživných roztoků, které mají optimální složení z hlediska fyziologických potřeb a jsou využívány především k syntéze tkáňových proteinů, případně k zajištění energetických nároků, dále roztoků specializovaných, kde aminokyseliny mají farmakologicku úlohu a výrazně ovlivňují metabolické funkce. Této vlastnosti aminokyselin je využíváno ve speciálních orgánově specifických aminokyselinových přípravcích, které jsou určeny k léčbě jaterního selhání, renální nedostatečnosti, sepse, poruch imunity a dalších speciálních situací.(5,6,7) Doporučené dávkování aminokyselin u dospělých a dětí je uvedeno v tabulce č. 1.
Postup při praktickém stanovení potřeby aminokyselin parenterální výživy
Potřeba aminokyselin se pohybuje ve většině případů v rozmezí 0,75-2 g na kg tělesné hmotnosti a den. Přesnější hodnotu vypočítáme dle odpadů urey do moči.(5) Při účelném používání zdrojů aminokyselin musíme vzít v úvahu skutečnost, že u těžkého katabolismu nelze dusíkovou bilanci vyrovnat bez zvládnutí základního onemocnění, dále že je nutné stanovit optimální poměr mezi přívodem neproteinových energetických zdrojů a dusíku bílkovin. Tento poměr se pohybuje kolem 200 kcal (×4,16 kJ) nebílkovinné energie na 1 g dusíku bílkovin u stabilizovaného pacienta a 100-150 kcal neproteinové energie na 1 g dusíku bílkovin u nemocného ve stresu a pokročilém katabolismu. S výhodou je dnes často užívané podání aminokyselin v systému "ALL-IN-ONE" (AIO). Tento systém je založen na podání energetických substrátů (glukózy, tukové emulze) společně s aminokyselinami, elektrolyty, vitaminy a stopovými prvky dohromady tak, jak by se objevily v plazmě nemocného v postprandiálním stavu. Podání nebílkovinných energetických substrátů společně s aminokyselinami zabrání využití aminokyselin jako zdroje energie a umožní jejich preferenční využití k proteosyntéze.
A. Parenterální výživa u chorob ledvin
Chronická renální onemocnění: insuficience (CHRI) a selhání
U nemocných s CHRI používáme parenterální výživu v průběhu interkurentních onemocnění a komplikací, nebo jako doplňkovou adjuvantní léčbu v průběhu dialýzy.
1. Kontinuální parenterální výživa
Látková přeměna nemocných s CHRI je labilní a při akutních onemocněních nebo komplikacích (infekce apod.) dochází k metabolickému selhání a katabolismu tělesných bílkovin. Parenterální výživa obvykle vede ke stabilizaci metabolické poruchy a zachování reziduální funkce ledvin.
Abychom zajistili stejnoměrné využití podávaných živin, aplikujeme infuze plynule po 24 hodin denně. Pokračujeme i v průběhu dialýz.
2. Doplňková parenterální výživa v průhěhu dialýzy
U nemocných s CHRI zjišťujeme celou řadu výživových karencí. Pomocí doplňkové parentrální výživy se snažíme dlouhodobě zlepšit stav výživy infuzemi podávanými v průběhu dialýz. Dříve se soudilo, že je-li infuzní léčba prováděna v průběhu dialýzy, značně se zvýší dialýzou podmíněné ztráty živin, a proto se doporučovalo podávat roztoky až v posledních 90 minutách dialýzy, nebo po jejím ukončením. Podle současných názorů je celková ztráta aminokyselin za dobu dialýzy jen nepatrně zvýšena. Organismus retinuje více než 80 % podaných aminokyselin.
Hlavními prostředky doplňkové parenterální výživy v průběhu hemodialýzy jsou infuzní roztoky s aminokyselinami a glukózou. Dosud není zcela jasné, zda je výhodnější podávat fortifikované směsi s esenciálními aminokyselinami, nebo standardní aminokyselinové směsi. Jestliže podáváme dávku aminokyselin větší než 20 g při jedné dialýze (což se zdá být účelné vzhledem k léčebnému záměru), je lépe zvolit kompletní směs aminokyselin. I při podávání esenciálních aminokyselin byly potiž pozorovány aminokyselinové dysbalance.
Infuzní doplňkovou léčbu provádíme jen u těch nemocných, kteří mají příznaky malnutrice a nelze u nich podat dostatečnou dávku živin perorálně.
Akutní poškození a selhání ledvin (AKI)
Parenterální výživa je u většiny případů AKI ve fázi oligoanurické formy selhání (AKIN 3) nezbytná alespoň v první fázi onemocnění. Pacient buď nechce, nemůže, nebo nesmí perorálně přijímat potřebnou dietu. Výhodné je zavedení centrálního žilního katétru, jímž lze podávat parenterální výživu, využít ho při dialýze a navíc kontrolovat poměry bilance tekutin měřením CŽT. Hlavní předností parenterální výživy je možnost volně upravovat složení výživných roztoků. Tak je možné zaměřit se cíleně a v krátkém časovém úseku na jednotlivé metabolické poruchy. Výživné látky podáváme nepřetržitě 24 hodin denně infuzní pumpou. Tím lze docílit dostatečný celkový přívod i při poruše jejich využití. Navíc to usnadňuje cílenou korekci jednotlivých metabolických poruch a průběžnou kontrolu látkové přeměny (glykemický profil apod.). Shoda je v doporučených dávkách aminokyselin u nemocných, jejichž stav vyžaduje dialyzační léčbu. Dávka činí 0,8 až 1,2 g aminokyselin na kg tělesné hmotnosti denně (přednostně směsi kyselin esenciálních a neesenciálních). Hlavním energetickým zdrojem je však glukóza. V poslední době podává většina autorů tukové emulze.(8,9)
Ke glukóze prvního litru infuzního roztoku jsou napřed přidávány aminokyseliny a teprve potom tuková emulze. Podle potřeby lze do směsi přidat elektrolyty a inzulin, dále stopové prvky a vitaminy. Aby bylo zajištěno optimální využití dodaných živin a aby nedošlo k metabolickým výkyvům, aplikují se infuze postupně zvyšovanou rychlostí. Na začátku je to přibližně 0,5 ml na kg hmotnosti za hodinu. V osmihodinových intervalech se rychlost zvyšuje vždy o 0,5 ml za hodinu až do dosažení standardních 1-1,5 ml/kg/hod. Uvedeným způsobem byli nemocní s AKI léčeni bez komplikací po dobu více než dvou měsíců.
B. Perorální suplementace aminokyselinami a jejich ketoanalogy
V chronické renální insuficienci byly opakovaně dokumentovány nálezy abnormálních hladin některých aminokyselin v plazmě a kosterním svalu. Bývají zjišťovány nízké koncentrace především esenciálních aminokyselin, zatímco hladina některých neesenciálních bývá zvýšena.(10)
Při metabolizaci aminokyselin je prvním krokem transaminace na odpovídající ketokyseliny. Tento pochod je reverzibilní, což má zásadní význam při užití ketoanalog esenciálních aminokyselin. Umožnuje tak příslušným ketokyselinám nahradit základní aminokyseliny v bílkovinách diety. Konečných produktem oxidace leucinu a izoleucinu je acetyl CoA, který může sloužit jako základní zdroj pro syntézu mastných kyselin. Při neúplné oxidaci leucinu vzniká hydroxymetyl-glutaryl-CoA, základní prekurzor cholesterolu. Valin se metabolizuje na sukcinyl CoA – intermediální metabolit Krebsova cyklu, který má glykogenní účinek. Důležitý je zejména vztah alaninového a glutaminového metabolismu k metabolismu rozvětvených aminokyselin. Rozvětvené aminokyseliny jsou zdrojem alfa-amino-dusíku pro syntézu glutaminu a alaninu. Alanin je přenašečem aminoskupin mezi kosterními svaly a játry, takže je možno říci, že rozvětvené aminokyseliny regulují sekundárně přenos alfa-amino-dusíku mezi periferními a viscerálními tkáněmi. Glutamin je přenašečem aminoskupin mezi kosterními svaly a ledvinami. Alanin a glutamin jsou také klíčovými substráty pro glukoneogenezi. Všechny tři rozvětvené aminokyseliny mají regulační vliv na proteinový metabolismus ve smyslu poklesu katabolismu a tendence k proteosyntéze. Největší protein šetřící účinek byl popsán u ketoanaloga leucinu. Vysoké koncentrace rozvětvených aminokyselin inhibují glukogenezi.
Významným pokrokem bylo nahrazení plnohodnotných esenciálních aminokyselin jejich keto- a hydroxyanalogy (KA). Uskutečněné studie využily mechanismu reverzibilní transaminace vybraných esenciálních aminokyselin.(11) Podáváním bezdusíkatých „uhlíkových skeletů" esenciálních aminokyselin ve formě jejich keto- a hydroxyanalogů vedlo jak k výraznému snížení příjmu exogenního dusíku do organismu, tak k využití části dusíku retinované močoviny k aminaci těchto aminokyselin. Formou ketoanalog byly podávány aminokyseliny leucin, izoleucin, valin, fenylalanin a methionin. Ostatní esenciální aminokyseliny byly podávány ve své L-formě (lysin, treonin a tryptofan), neboť jejich aminace v organismu byla metabolicky náročná a méně efektivní. V sestavě aminokyselin byly doplněny histidin a tyrozin. V našich podmínkách nebyly většinou prokázány snížené hladiny histidinu, ale jeho využitelnost vázne. Histidin významně zlepšuje dusíkovou bilanci a podílí se i na stabilizaci krevního obrazu.
Zatímco minimální denní potřeba esenciálních aminokyselin pro zdravé osoby byla stanovena již před 40 lety, není otázka adekvátní úhrady esenciálních aminokyselin u nemocných v chronické renální insuficienci dodnes zcela vyřešena.
U nás dostupné přípravky mají ketoanaloga vázána ve formě kalciových solí, což znamená při obsahu např. 50 mg kalcia v 1 tbl. přípravku Ketosteril nezanedbatelný přísun kalcia.
Vedle ketoanalog lze podávat u nemocných v chronické renální insuficienci při nízkobílkovinné dietě též přípravky esenciálních aminokyselin. Podání samotných aminokyselin se však dlouhodobě příliš neosvědčilo, neboť stejného účinku lze dosáhnout při menších nákladech přidáním malého množství biologicky vysoce hodnotné bílkoviny, či lépe oligopeptidů (navíc je příjem většího množství aminokyselin spojen s nebezpečím prohloubení metabolické acidózy). Podáváme je krátkodoběji především tam, kde metabolická aktivace ketoanalog (aminace) je porušena – u nemocných s jaterní lézí, v těžkém metabolickém stavu, u diabetiků apod. Také tyto přípravky obsahují vedle osmi esenciálních aminokyselin histidin a tyrozin. Neobsahují kalcium.
Velikost dávky ketoanalog či esenciálních aminokyselin je závislá na bílkovinném složení diety, hmotnosti nemocného a jeho nutričním stavu. Při neselektivní nízkobílkovinné dietě se udává dávka 0,1-0,2 g aminokyselin/kg/den. Minimální dávka nezbytná k udržení dusíkové rovnováhy při naší dietě činila 4,8 g/den (přípravek Ketosteril).
Kontraindikace v podávání ketoanalog jsou hyperkalcemie, uremická gastrointestinální symptomatologie a těžká jaterní léze. Pro nedostatek klinických zkušeností se nedoporučuje podávat přípravek v těhotenství.
prof. MUDr. Vladimír Teplan, DrSc.
Subkatedra nefrologie IPVZ /IKEM
e-mail:vladimir.teplan@seznam.cz